Judul : Ilmu Kimia Pengertian reaksi Reduksi - Oksidasi (Redoks) serta Aplikasi nya dalam Kehidupan Sehari hari blog kimia
link : Ilmu Kimia Pengertian reaksi Reduksi - Oksidasi (Redoks) serta Aplikasi nya dalam Kehidupan Sehari hari blog kimia
Ilmu Kimia Pengertian reaksi Reduksi - Oksidasi (Redoks) serta Aplikasi nya dalam Kehidupan Sehari hari blog kimia
Teori ilmukimia - Redoks atau reaksi reduksi/oksidasi adalah perubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia. Istilah redoks bermakna dua yakni reduksi dan oksidasi yang dapat dijelaskan sebagai berikut:
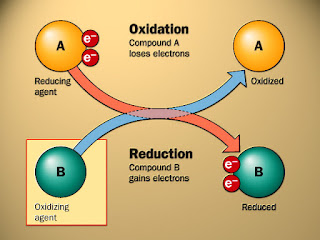
Oksidasi adalah pelepasan elektron oleh sebuah molekul, atom, atau ion
Sedangkan Reduksi adalah penambahan elektron oleh sebuah molekul, atom, atau ion.
Istilah penambahan atau pelepasan elektron tidak selalu benar. Oksidasi dan reduksi lebih tepatnya berarti perubahan bilangan oksidasi karena transfer elektron sebenarnya tidak akan selalu terjadi. Sehingga oksidasi lebih baik didefinisikan sebagai peningkatan bilangan oksidasi, dan reduksi sebagai penurunan bilangan oksidasi. Dalam prakteknya, transfer elektron akan selalu mengubah bilangan oksidasi, namun terdapat banyak reaksi yang diklasifikasikan sebagai "redoks" walaupun tidak ada transfer elektron dalam reaksi tersebut (misalnya yang melibatkan ikatan kovalen).
Reaksi non-redoks yang tidak melibatkan perubahan muatan formal dikenal sebagai reaksi metatesis.
1. Oksidator dan Reduktor
Senyawa-senyawa yang memiliki kemampuan untuk mengoksidasi senyawa lain dikatakan sebagai oksidator atau yang mengalami reduksi. Oleh karena ia "menerima" elektron, ia juga disebut sebagai penerima elektron. Contoh Oksidator adalah senyawa-senyawa yang memiliki unsur-unsur dengan bilangan oksidasi yang tinggi (seperti H2O2, MnO4−, CrO3, Cr2O72−, OsO4) atau senyawa-senyawa yang sangat elektronegatif, sehingga dapat mendapatkan satu atau dua elektron yang lebih dengan mengoksidasi sebuah senyawa (misalnya oksigen, fluorin, klorin, dan bromin).
Senyawa-senyawa yang memiliki kemampuan untuk mereduksi senyawa lain dikenal sebagai reduktor atau yang mengalami oksidasi. Oleh karena ia "mendonorkan"elektronnya, ia juga disebut sebagai pemberi elektron. Senyawa-senyawa yang berupa reduktor sangat bervariasi. Unsur-unsur logam seperti Li, Na, Mg, Fe, Zn, dan Al dapat digunakan sebagai reduktor. Logam-logam ini akan memberikan elektronnya dengan mudah.
Cara yang mudah untuk melihat proses redoks adalah, reduktor mentransfer elektronnya ke oksidator. Sehingga dalam reaksi, reduktor melepaskan elektron dan teroksidasi, dan oksidator mendapatkan elektron dan tereduksi. Pasangan oksidator dan reduktor yang terlibat dalam sebuah reaksi disebut sebagai pasangan redoks.
2. Contoh reaksi redoks
Contoh reaksi redoks adalah antara lain
- Reaksi antara Hidrogen dan Flourin
Kita dapat menulis keseluruhan reaksi ini sebagai dua reaksi setengah:
Reaksi oksidasi
Reaksi reduksi
Analisa masing-masing reaksi setengah akan menjadikan keseluruhan proses kimia lebih jelas. Karena tidak terdapat perbuahan total muatan selama reaksi redoks, jumlah elektron yang berlebihan pada reaksi oksidasi haruslah sama dengan jumlah yang dikonsumsi pada reaksi reduksi.
Unsur-unsur, bahkan dalam bentuk molekul, sering kali memiliki bilangan oksidasi nol. Pada reaksi di atas, hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sedangkan fluorin tereduksi dari bilangan oksidasi 0 menjadi -1.
Ketika reaksi oksidasi dan reduksi digabungkan, elektron-elektron yang terlibat akan saling mengurangi:
Dan ion-ion akan bergabung membentuk hidrogen fluorida:
· Hidrogen peroksida tereduksi menjadi hidroksida dengan keberadaan sebuah asam:
H2O2 + 2 e− → 2 OH−
Persamaan keseluruhan reaksi di atas adalah:
2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O
· Denitrifikasi, nitrat tereduksi menjadi nitrogen dengan keberadaan asam:
2NO3− + 10e− + 12 H+ → N2 + 6H2O
- Besi akan teroksidasi menjadi besi(III) oksida dan oksigen akan tereduksi membentuk besi(III) oksida (umumnya dikenal sebagai perkaratan):
4Fe + 3O2 → 2 Fe2O3
· Pembakaran hidrokarbon, contohnya pada mesin pembakaran dalam, menghasilkan air, karbon dioksida, sebagian kecil karbon monoksida, dan energi panas. Oksidasi penuh bahan-bahan yang mengandung karbon akan menghasilkan karbon dioksida.
- Dalam kimia organik, oksidasi seselangkah (stepwise oxidation) hidrokarbon menghasilkan air, dan berturut-turut alkohol, aldehida atau keton, asam karboksilat, dan kemudian peroksida.
Selesai sudah artikel kami tentang Ilmu Kimia Pengertian reaksi Reduksi - Oksidasi (Redoks) serta Aplikasi nya dalam Kehidupan Sehari hari blog kimia
kami berharap artikel Ilmu Kimia Pengertian reaksi Reduksi - Oksidasi (Redoks) serta Aplikasi nya dalam Kehidupan Sehari hari blog kimia ini, mudah-mudahan bisa menjadi sumber informasi dan pelajaran bagi kita semua. Sampai bertemu diartikel kami selanjutnya
Anda saat ini sedang membuka halaman artikel Ilmu Kimia Pengertian reaksi Reduksi - Oksidasi (Redoks) serta Aplikasi nya dalam Kehidupan Sehari hari blog kimia dengan alamat link https://ilmukimiamu.blogspot.com/2018/02/ilmu-kimia-pengertian-reaksi-reduksi.html
Dapatkan Sample GRATIS Produk sponsor di bawah ini, KLIK dan lihat caranya





Tidak ada komentar:
Posting Komentar