Judul : Ilmu Kimia Teori Atom Dalton, J.J. Thomson, Rutherford, Bohr dan Mekanika Gelombang blog kimia
link : Ilmu Kimia Teori Atom Dalton, J.J. Thomson, Rutherford, Bohr dan Mekanika Gelombang blog kimia
Ilmu Kimia Teori Atom Dalton, J.J. Thomson, Rutherford, Bohr dan Mekanika Gelombang blog kimia
Teori kimia - Teori atom berdasarkan penemunya terdapat beberapa jenis teori, diantaranya adalah sebagai berikut :
1. Teori atom Dalton
Dasar-dasar teori atom modern dimulai oleh John Dalton, yang mempostulatkan bahwa unsur-unsur tersusun atas partikel-partikel yang luar biasa kecil yang disebut atom, dan semua atom dari suatu unsur identik , tetapi berbeda dari atom-atom unsur yang lain.
Teori Dalton tersebut didasari oleh beberapa hukum yakni,
- Hukum perbandingan tetap (Joseph Proust) menyatakan bahwa sampel – sampel yang berbeda dari senyawa yang sama selalu mengandung unsur-unsur penyusunnya dengan perbandingan massa yang sama.
- Hukum perbandingan berganda menyatakan bahwa jika dua unsur dapat bergabung membentuk lebih dari satu senyawa, maka massa-massa dari unsur yang pertama dengan satu massa tetap dari unsur yang kedua akan berbading sebagai bilangan bulat yang sederhana.
- Hukum kekekalan massa menyatakan bahwa materi tidak dapat diciptakan dan tidak dapat dimusnahkan. (Chang, 2004)
Teori atom Dalton dapat dilihat pada Gambar 1.
2. Teori Atom J.J. Thomson (Teori atom roti kismis)
Teori atom J.J Thompson didasari pada percobaan dengan menggunakan tabung katoda. Thomson menemukan bahwa apabila tabung katoda di beri tegangan tinggi maka suatu “sinar” yang disebut sebagai “sinar katoda” akan dihasilkan. Karena sinar ini muncul pada elektroda negatif dan sinar ini menolak kutub negatif dari medan listrik yang diaplikasikan ke tabung katoda maka Thompson menyatakan bahwa sinar katoda tersebut tidak lain adalah aliran partikel bermuatan negatif yang dikemudian hari disebut sebagai elektron. Dengan mengganti katoda menggunakan berbagai macam logam maka Thompson tetap menghasilkan jenis sinar yang sama.
Berdasarkan hal ini maka Thompson menyatakan bahwa setiap atom pasti memiliki elektron, karena atom bersifat netral maka dalam atom juga harus megandung sejumlah muatan positif. Sehingga teori atom Thomson menyatakan bahwa,
“Atom terdiri dari awan bermuatan positif yang terdistribusi sedemikian rupa dengan muatan negatif tersebar secara random di dalamnya”.
Teori atom Thomson dapat dilihat pada Gambar 2.
3. Teori Atom Rutherford
Ernest Rutherford dan kawan-kawannya melakukan percobaan melewatkan sinar dalam tabung yang berisi gas. Ternyata sinar bergerak lurus tanpa dipengaruhi oleh gas. Mereka menduga bahwa molekul gas tidak bermuatan dan tidak mengubah arah sinar yang bermuatan positif.
Berdasarkan hal ini Rutherford berhipotesis bahwa partikel dalam padatan akan berubah arah, karena dalam atom terdapat muatan positif. Hipotesis ini dibuktikan oleh Geiger dan Marsden, yang menembakkan sinar pada selempeng platina tipis. Hasilnya ditangkap dengan layar yang terbuat dari ZnS yang dapat berfluoresensi bila kena sinar .
Hasil pengamatan menunjukkan bahwa sinar yang ditembakkan itu ada yang tembus, membelok, dan memantul. Sinar yang tembus merupakan bagian terbesar, sedangkan yang membelok sedikit, dan yang memantul sedikit sekali. Gejala ini dijelaskan oleh Rutherford, bahwa partikel banyak yang tembus disebabkan oleh atom yang mengandung banyak ruang hampa.
Di pusat atom terdapat sebuah partikel bermuatan positif yang disebut inti. Sinar akan membelok bila mendekati inti, karena saling tolak menolak. Kejadian ini sedikit jumlahnya karena ukuran inti atom sangat kecil dibandingkan ukuran ruang hampanya. Jika ada partikel yang menabrak inti, maka akan memantul walaupun tidak 180o. Tumbukan langsung ini sangat kecil kemungkinannya, maka jumlah yang memantul kecil sekali.
Di luar inti tidak hanya kosong, tetapi terdapat elektron yang berputar mengelilinginya. Elektron tidak mempengaruhi arah sinar karena elektron sangat kecil dan ringan. Dengan penalaran seperti itulah Rutherford menggambarkan atom terdiri dari inti yang bermuatan positif yang merupakan terpusatnya massa, dan di sekitar inti terdapat elektron yang bergerak mengelilinginya dalam ruang hampa (Gambar 3).
Kelemahan teori Rutherford ini adalah ketidakmampuannya menerangkan mengapa elektron tidak jatuh ke inti atom akibat gaya tarik elektrostatik inti terhadap elektron.
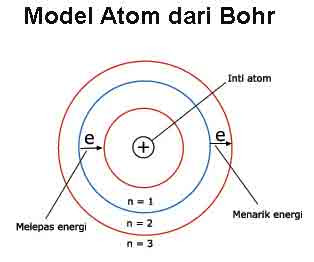
4. Teori Atom Bohr
Penyempurnaan model atom Rutherford yang berkaitan dengan lintasan elektron dilakukan oleh murid Rutherford sendiri, yang bernama Niels Bohr.
Bohr memiliki pendapat sebagai berikut :
- Elektron beredar mengelilingi inti atom dengan tingkat-tingkat energi tertentu. Semakin dekat ke inti atom, tingkat energi semakin rendah. Dan sebaliknya, semakin jauh dari inti atom, tingkat energi semakin tinggi. Tingkat-tingkat energi ini membentuk lintasan elektron yang berupa lingkaran. Peredaran elektron dalam lintasannya tersebut tidak membebaskan atau menyerap energi, sehingga bersifat stabil.
- Perpindahan elektron dapat terjadi dengan cara : Menyerap energi sehingga elektron tersebut berpindah ke tingkat energi yang lebih tinggi atau lintasan yang lebih luar atau membebaskan energi sehingga elektron tersebut berpindah ke tingkat energi yang lebih rendah atau lintasan yang lebih dalam.
Energi yang dibebaskan saat elektron berpindah ke tingkat energi yang lebih rendah dapat diamati sebagai pancaran cahaya dengan panjang gelombang tertentu. Spektrum cahaya atau gelombang elektromagnetik pada atom hidrogen dijadikan bukti oleh Bohr untuk mendukung teorinya (Gambar 4).
Kelemahan teori atom Bohr adalah hanya dapat menerangkan spektrum atom dari atom atau ion yang mengandung satu elektron dan tidak sesuai dengan spektrum atom atau ion berelektron banyak.
5. Teori Atom Mekanika Gelombang
Model atom mekanika gelombang menggambarkan sifat pergerakan elektron dan kedudukan elektron. Dasar pertama model atom mekanika gelombang ini adalah hipotesis de Broglie. Jika menurut Bohr elektron bergerak mengelilingi inti, maka menurut teori Broglie, gerakan itu bukanlah dalam lintasan teretentu melainkan dalam bentuk gelombang.
Dasar kedua adalah asas ketidakpastian Heisenberg, kedudukan elektron tidak dapat ditentukan secara pasti, karena elektron yang bergerak di sekitar inti memiliki posisi dan momentum tertentu pada setiap saat. Akibatnya, kita tidak mungkin mengetahui lintasan elektron, seperti dikemukakan oleh Bohr dan yang dapat ditentukan hanya orbital. Orbital adalah daerah kebolehjadian atau peluang ditemukannya elektron. Lintasan bergeraknya elektron bukan merupakan sebuah garis yang pasti, melainkan sebuah ruang.
Selesai sudah artikel kami tentang Ilmu Kimia Teori Atom Dalton, J.J. Thomson, Rutherford, Bohr dan Mekanika Gelombang blog kimia
kami berharap artikel Ilmu Kimia Teori Atom Dalton, J.J. Thomson, Rutherford, Bohr dan Mekanika Gelombang blog kimia ini, mudah-mudahan bisa menjadi sumber informasi dan pelajaran bagi kita semua. Sampai bertemu diartikel kami selanjutnya
Anda saat ini sedang membuka halaman artikel Ilmu Kimia Teori Atom Dalton, J.J. Thomson, Rutherford, Bohr dan Mekanika Gelombang blog kimia dengan alamat link http://ilmukimiamu.blogspot.com/2018/02/ilmu-kimia-teori-atom-dalton-jj-thomson.html
Dapatkan Sample GRATIS Produk sponsor di bawah ini, KLIK dan lihat caranya



Tidak ada komentar:
Posting Komentar